pH ve pOH Nedir?
Sulu olan çözeltilerde bulunan OH– ve H3O+ iyonlarının değerleri çok düşüktür. Bu nedenle pH ve pOH kavramları kullanılmaktadır. Peki pH ve pOH kavramları nedir?
→ Hidrojen iyonunun derişiminin (birim mol/litre) eksi logaritmasına pH denir. Yani pH Hidrojen gücünü ifade eder.
pH = -log[H+]
→ Hidroksit (OH–) derişiminin (birim mol/litre) eksi logaritmasına pOH denir. Yani pOH hidroksil gücünü ifade eder.
pOH = -log[OH+]
pH – pOH Kavramı
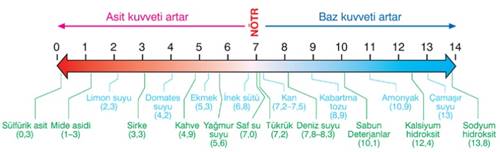
pH ve pOH kavramları bir sulu çözeltinin asidik mi yoksa bazik mi olduğunu bize gösterir. Yani:
pH değeri 7 değerinin altına düştükçe asitlik artar, 7 değerinin üstüne çıktıkça bazlık artar. Aynı şekilde pOH değeri 7 değerinin altına düştükçe bazlık artar, 7 değerinin üstüne çıktıkça asitlik artar. Ama her ikisinde de değer eğer 7 ise sulu çözelti nötrdür. Şimdi bunu bir tablo ile açıklayalım.
pH → ……. 0 ……………. 7 ………. 14…….
…….. Asitlik Artar ← Nötr → Bazlık Artar
pOH → ……. 0 …………. 7 ………. 14…….
………. Bazlık Artar ← Nötr → Asitlik Artar
pH + pOH Değeri
Sulu çözeltilerde sıcaklık 25ºC’de pH ve pOH toplamı 14’tür. Ama farklı sıcaklıklarda bu değer farklı olabilir.