Kovalent ve İyonik Bağlar Arasındaki Fark Nedir Örnekler ve Özellikleri
Kovalent ve İyonik Bağlar Arasındaki Fark Nedir Örnekler ve Özellikleri başlıklı yazımızda sizlere bu konuda detaylı bilgi vermeye çalışacağız. Eğer daha fazla bilgiye ihtiyacınız olursa sitemizde arama yaparak bu bilgilere ulaşabilirsiniz. Şimdi yazımıza geçelim. İki tür atomik bağ vardır – iyonik bağlar ve kovalent bağlar. Yapıları ve özellikleri bakımından farklılık gösterir. Kovalent bağlar, iki atom tarafından paylaşılan elektron çiftlerinden oluşur ve atomları sabit bir doğrultuda bağlar. Bunları kırmak için nispeten yüksek enerjiler gerekir (50 – 200 kcal / mol). İki atomun bir kovalent bağ oluşturup oluşturamayacağı elektronegatifliğine, yani bir moleküldeki bir atomun elektronun kendisine çekilmesi gücüne bağlıdır. Eğer iki atom elektronegatifliğinde önemli ölçüde farklılık gösteriyorsa (sodyum ve klorür gibi), atomlardan biri elektronunu diğer atoma verecektir. Bu, pozitif yüklü bir iyon (katyon) ve negatif yüklü iyon (anyon) ile sonuçlanır. Bu iki iyon arasındaki bağa da iyonik bağ denir. Bu kısa girişten sonra şimdi konuyu biraz daha detaylandıralım isterseniz.
Açıklayıcı Tablo
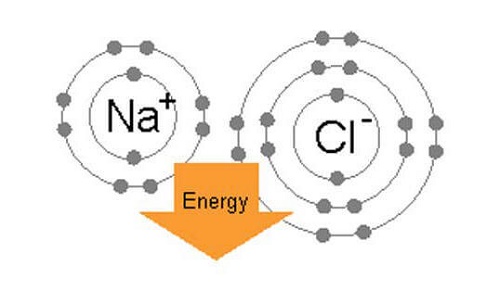
Kovalent ve İyonik Bağlar Arasındaki Fark Nedir Örnekler ve Özellikleri başlıklı yazımızda biraz daha detaya indiğimizde sizlere şunları aktarabiliriz. İyonik Bağ
Kimya alanına ait Kovalent ve İyonik Bağlar Arasındaki Fark Nedir Örnekler ve Özellikleri konusu hakkında daha fazla bilgiye sahip olabilirsiniz. Bunun için gerek sitemizden gerekse farklı kaynaklardan araştırma yapabilirsiniz. Yazımıza devam edecek olursak şunları da aktarabiliriz. Şimdi kaldığımız yerden devam edelim. Yazımıza şöyle devam edebiliriz. Kovalent bağ, iki atomun elektronları paylaşabildiği zaman oluşur, oysa iyonik bağın sonunda bir çift iyon oluşur ve A atomundaki elektron, B atomuna verilmiş olur. Her atom proton, nötron ve elektronlardan oluşur. Atomun merkezinde, nötronlar ve protonlar birlikte bulunur. Fakat elektronlar merkez etrafında yörüngede döner. Bu moleküler yörüngelerin her biri, kararlı bir atom oluşturmak için belirli sayıda elektrona sahip olabilir. Ancak soy gazlar haricinde, bu konfigürasyon atomların çoğunda mevcut değildir. Böylece atomu stabilize olmak için, her bir atom elektronlarının yarısını paylaşır. Son olarak bu konu hakkında geçmişte birçok araştırma yapıldığı gibi bundan sonra da araştırmalar yapılmaya devam edecek ve yeni bilgiler bizlere ulaştırılacaktır. Bilgiyle kalın…
