İdeal Gaz Davranışından Sapmalar
Taneciklerinin birbirlerine çekme ve itme kuvveti uygulamadıkları gazlara ideal gaz denilmektedir. Diğer bir deyişle bütün gaz yasalarına uyan, molekülleri birbirinden etkilenmeyen ve moleküller arası çekim kuvveti olmayan gazlara İdeal Gazlar denir. İdeal gazlar ile ilgili yazımızı BURADAN okuyabilirsiniz. İdeal gazlar ile ilgili diğer bir kabul ise gaz moleküllerinin hacimlerinin kabin hacmi yanında ihmal edildiğidir. Bütün bunların yanı sıra gerçek hayatta hiçbir gaz ideal gaz değildir.
İLGİNİZ ÇEKEBİLİR: Gaz Yasası Nedir? Gaz Yasaları Nelerdir?
Basınç Değiştirildiğinde Gaz Davranışındaki Sapmalar
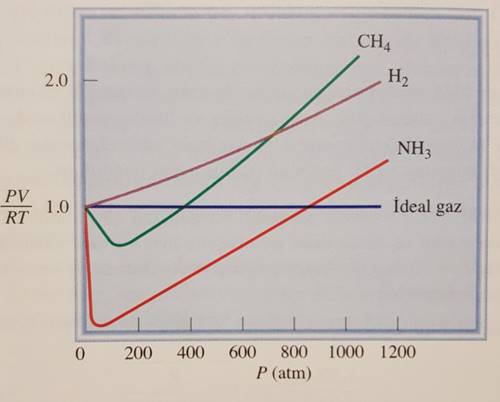
Aşağıda verdiğimiz resimde ideal bir gaz ile 3 farklı gerçek gazın sabit sıcaklıkta basınca karşı PV/RT grafiği gösterilmektedir. Buna göre 1 mol gaz için (Çünkü PV=nRT formülündeki n=1 olduğu zaman) PV/RT=1 olur.
Bu durum düşük basınç değerlerinde geçerlidir. Ama basınç arttıkça sapmalarda artmaktadır. Örnek olarak atmosfer basıncında moleküller arası mesafe fazla olduğundan çekim kuvvetleri ihmal edilebilecek seviyededir. Ama yüksek basınçlarda gazların yoğunluğu arttığı için moleküller birbirlerine yaklaşırlar ve dolayısıyla çekim kuvvetleri de artar. Böyle bir durumda da çekim kuvveti ihmal edilemeyecek seviyede olur ve bu gaz ideal gaz olmaktan çıkar.
Sıcaklık Değiştirildiğinde Gaz Davranışındaki Sapmalar
Bir gazın ideal gaz davranışından sapmasını görebilmenin bir diğer yolu da sıcaklığı düşürmektir. Bir gazın sıcaklığı düşürülürse gaz moleküllerinin kinteik enerjileri azalır ve böylece moleküller arası çekim kuvveti artar.
Van Der Waals Yaklaşımı
Gerçek gazları doğru olarak inceleyebilmek için gaz moleküllerinin çekim kuvvetlerini ve bu moleküllerin hacimlerini göz önüne almak gerekir. Bunu ilk defa 1873 yılında J. D. Van Der Waals yapmıştır. Van Der Waals, yaptığı yaklaşımla gerçek gaz davranışlarını moleküler seviyede açıklayabilmiştir. Buna göre:
Pideal = Pgöz + (a x n2 / V2)
Pideal = İdeal basınç
Pgöz = Gözlenen basınç
a = orantı sabit sayı
n = gazın mol sayısı
V = gazın hacmi
Diğer bir düzeltme terimi, gaz molekülleri tarafından kaplanan hacimle ilgilidir. Sonuç olarak:
[P + (a x n2 / V2)] x (V – n x b) = n x R x T
[P + (a x n2 / V2)] = düzeltilmiş basınç
V – n x b = düzeltilmiş hacim
b = sabit sayı
Yukarıda verdiğimiz son formül { [P + (a x n2 / V2)] x (V – n x b) = n x R x T }, ideal olmayan bir gazın P, V, T ve n değerlerine bağlı Van Der Waals denklemi vermektedir.
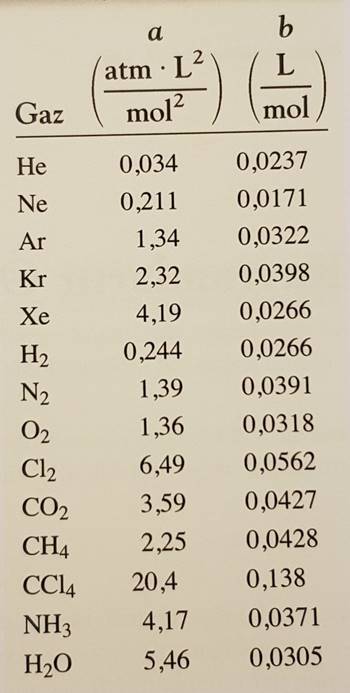
Yukarıda verdiğimiz a ve b sabitleri gazlar için belirlenmiştir. Buna göre bazı gazların a ve b sabitleri aşağıdaki gibidir:
a = atm x L2 / mol2
b = L / mol