Çözünme Olayında Kimyasal Türler Arası Etkileşimler Nedir?
Çözünme olayında kimyasal türler arası etkileşimler konusuna geçmeden önce çözünme olayının kısaca tanımını yapmalım. Çözünen ve çözücü maddelerin iyonlarına ve moleküllerine kadar birbiri içerisine kadar ayrılmasına, diğer bir deyişle bir maddenin moleküllerinin ve iyonlarının diğer maddenin iyonlarının ve moleküllerinin arasına girmesine Çözünme denir.
Kimyasal Bağların Oluşum Mekanizması
Kimyasal türler arası etkileşimler aracılığıyla meydana gelen kimyasal bağlarda atom çekirdeğine en uzak olan elektron etkileşime girer ve bu elektrona yani atomun dış katmanındaki elektrona/elektronlara Değerlik Elektron denir.
Birbirinden bağımsız aynı ya da farklı iki kimyasal tür birbirlerine yaklaştığı zaman hem bir elektron bulutu hemde çekirdekler arası bir elektrostatik çekim meydana gelir. Bu elektrostatik çekim sonucu ise çekme ve itme kuvvetleri ortaya çıkar. Pozitif ve negatif yükler birbirlerini iterler.
İLGİNİZİ ÇEKEBİLİR: Kimyasal Türler Nedir? Kimyasal Türler Konu Anlatımı
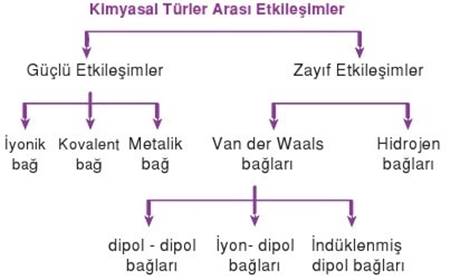
Kimyasal Türler Arası Etkileşimlerin Sınıflandırılması
Kimyasal türler arası etkileşimler 2 çeşittir. Bunlar:
1 – Güçlü Etkileşimler
1-A) İyonik bağ
1-B) Kovalent bağ
1-C) Metalik bağ
2 – Zayıf Etkileşimler
2-A) Hidrojen bağları
2-B) Van der Waals bağları
2-B-1) Dipol-dipol- bağları
2-B-2) İyon-dipol bağları
2-B-3) İndüklenmiş dipol bağları
Güçlü Etkileşimler
Kimyasal türler arasında meydana gelen etkileşimlerde eğer çekme kuvvetleri itme kuvvetlerinden çok fazla büyükse bu etkileşimlere Güçlü Etkileşimler denir ve bu tür etkileşimler kimyasal bağlar oluştururlar.
İyonik Bağ
Kimyasal türler arası etkileşimler içinde ilk etkileşim olan iyonik bağda elektronegatiflikleri çok farklı olan atomlar arasında elektron alışverişi tam olur ve sonuçta iyonların oluştuğu varsayılır. Elektron kaybeden pozitif iyon yani Katyon, elektron alan ise negatif iyon yani Anyon olur. Dolayısıyla pozitif ve negatif iyonlar arasında elektrostatik bir çekme kuvveti oluşur ve bu kuvvete İyonik Bağ denir.
Kovalent Bağ
Atomlar daha kararlı hale gelebilmek için iki veya daha fazla elektronu ortaklaşa kullanılırlar ve böylece aralarında kimyasal bir bağ oluşur. Oluşan bu kimyasal bağa Kovalent Bağ denir. Ortaya çıkan bileşiklere ise Kovalent Bağlı Bileşikler denir. Kovalent bağ ametaller arasında oluşur. Örnek olarak H2, O2, CO2, H2O, NH3, CH4, C2H6 gibi moleküller verilebilir.
Metalik Bağ
Metal atomlarda gevşek bağlı değerlik elektronları bulunmaktadır. Bu elektronlar diğer metal atomlarında bulunan eş enerjili boş değerlik orbitalleri arasında gezinirler. Bu şekilde çok sayıda elektronların metal atomları arasında gezinmesiyle bir elektron denizi oluşur. Bu sırada elektron kaybeden atomlar ise pozitif yüklü iyon (Katyon) haline gelir.
Zayıf Etkileşimler
Çekme kuvvetleri itme kuvvetlerinden az büyükse bu etkileşimlere Zayıf Etkileşimler denir ve bu tür etkileşimler fiziksel bağlar oluştururlar.
Dipol Nedir?
Dipol, kimyasal türler eğer iki kutuplu ise bunlara dipol denir. Yani bir kimyasal tür pozitif ve negatif kutup bulunduruyorsa (elektron yük yoğunluğu eşit dağılmamış bir yapı içeriyorsa) iki kutuplu anlamına gelen dipol terimi kullanılır. Kimyasal türlerde elektron yoğunluğunun fazla olduğu yere negatif kutup, elektron yoğunluğunun az olduğu yere ise pozitif kutup denir.
Van Der Waals Bağları
Kalıcı dipol ve indüklenmiş dipole sahip olan kimyasal türlerin kendi aralarında ve diğer türler ile yaptığı her türlü fiziksel bağ Van Der Waals bağıdır. Yalnız hidrojen bağı hariç.
Dipol – Dipol Bağları
Polar moleküller arasında oluşan bağ türüne denir. İki polar molekül birbirine yaklaşırken birinin pozitif kutbu ile diğerinin negatif kutbu arasında elektrostatik çekmeler oluşur ve bu çekmelere Dipol – Dipol Kuvvetleri denir.
İyon – Dipol Bağları
Bir iyonun polar bir molekül ile etkileşmesi sırasında oluşan bağ türüne denir. Katyonlar (pozitif yüklü iyonlar) molekülün negatif kutbu ile ve anyonlar (negatif yüklü iyonlar) molekülün pozitif kutbu ile etkileşir.
Hidrojen Bağları
Hidrojen bağının oluşabilmesi için hidrojenin molekülde bulunması gerekir. Hidrojen bağı, Van der Waals bağlarına göre yaklaşık olarak 10 kat daha güçlüdür. Hidrojen bağı oluşturan maddeler, birbiri içinde daha iyi çözünürler. Örnek olarak: C2H5OH (etil alkol) su molekülleriyle hem dipol – dipol bağları hemde hidrojen bağları oluştururlar. Bu yüzden etil alkol suda çok iyi çözünür.