Alkali Metaller ve Toprak Alkali Metallerin Özellikleri
Alkali Metaller ve Toprak Alkali Metallerin Özellikleri başlıklı yazımızda sizlere bu konuda detaylı bilgi vermeye çalışacağız. Eğer daha fazla bilgiye ihtiyacınız olursa sitemizde arama yaparak bu bilgilere ulaşabilirsiniz. Şimdi yazımıza geçelim. Çözünen metal hidroksitleri ve özellikle alkali metallerin hidroksitleridir. Alkali terimi çoğu zaman çözeltisi baz özelliği gösteren (asitleri nötralleştiren, turnusolu maviye çeviren) maddeler için de kullanılır. Örneğin,sodyum karbonatın çözeltisi baz özelliği gösterdiğinden alkali olarak nitelendirilir. Amonyak da alkali sınıfına girer. Bu kısa girişten sonra şimdi konuyu biraz daha detaylandıralım isterseniz.
Alkali
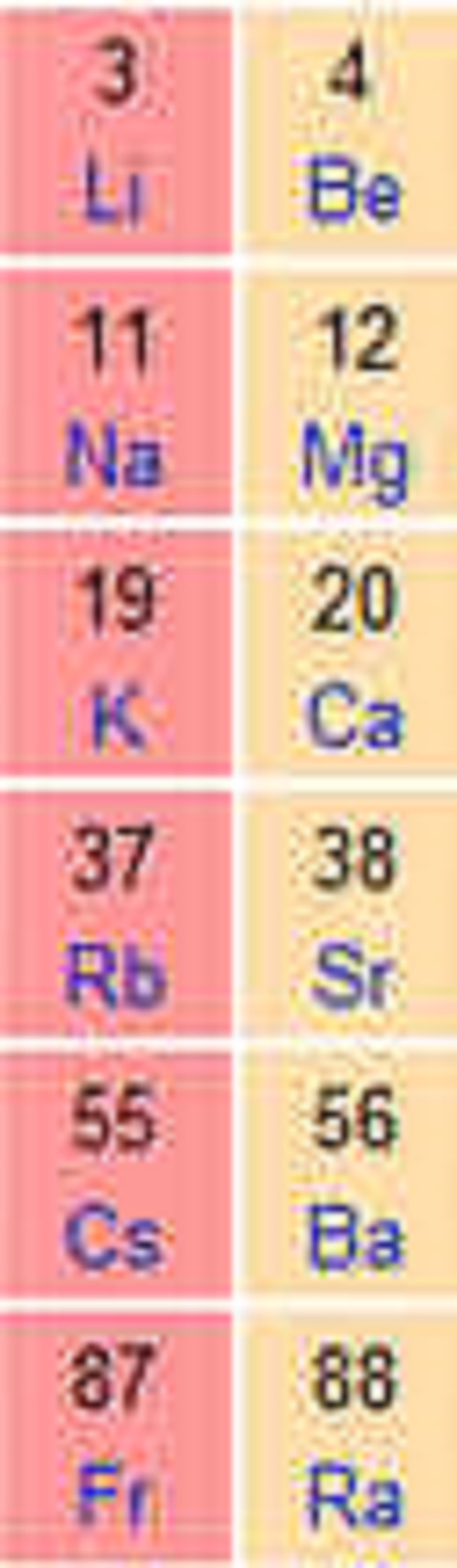
Alkali Metaller ve Toprak Alkali Metallerin Özellikleri başlıklı yazımızda biraz daha detaya indiğimizde sizlere şunları aktarabiliriz. Periyodik çizelgenin IA grubunu oluşturan elementlerdir. Bu metaller, sodyum (Na), rubidyum (Rb), fransiyum (Fr)’dur. Lityum, potasyumun yoğunlukları sudan büyüktür. Grupta atom numarasının artmasıyla birlikte iyon yarıçapı ve yoğunluğu artar; buna karşılık erime noktası ve elektronegatiftik azalır. Yerkabuğunda sodyum % 2,63, sodyum ve potasyum yerkabuğunda bol bulunan elementler arasındadır. Alkali metaller bileşiklerinde her zaman +1 yükseltgenme basamağında bulunurlar. Kimyasal bakımdan çok etkin olduklarından doğada serbest olarak bulunamazlar. Ametallerle doğrudan doğruya ve şiddetle tepkimeye girerek hidrojen çıkarırlar. Bu tepkimenin yavaş ve sakin olması nedeniyle laboratuvarlarda alkali-metal artıklarının yok edilmesi için etil alkol kullanılır.
Kimya alanına ait Alkali Metaller ve Toprak Alkali Metallerin Özellikleri konusu hakkında daha fazla bilgiye sahip olabilirsiniz. Bunun için gerek sitemizden gerekse farklı kaynaklardan araştırma yapabilirsiniz. Yazımıza devam edecek olursak şunları da aktarabiliriz. Şimdi kaldığımız yerden devam edelim. Yazımıza şöyle devam edebiliriz. Alkali metaller oksijenle birleşerek çeşitli oksitleri oluştururlar. Normal oksitler (M2O) suyla patlarcasına şiddetli bir biçimde birleşerek hidroksitleri oluştururlar. Sarı renkli peroksitlerin (M2O2) sulu çözeltileri metal hidroksit ile hidrojen peroksidin çözeltilerinin karışımı gibi davranır. Süperoksitler (MO2) turuncu renklidirler. Alkali metallerin peroksit ve süperoksitleri çok güçlü yükseltgen özellik gösterirler. Havanın oksijeni ve neminden hızla etkilenen alkali metaller, petrol eteri altmda saklanırlar. Üstleri donuk görünümlüdür. Taze kesilmiş yüzeyleri metalik parlaklık gösterir; fakat hızla donuklaşır. Alkali metaller Mx formülünde halojenürler (X=F,Cl, Br, I) MOH formülünde hidroksitler, M2SO4 formülünde sülfatlar, MNO3 formülünde nitratlar ve M2S formülünde sülfürler oluştururlar. Alkali metal sülfürleri suda kolaylıkla çözünürler ve hidroliz nedeniyle sulu çözeltileri güçlü bazik özellik gösterir. Amonyum iyonunun (NH4+) yarıçapı, potasyum ile rubidyumun iyon yarıçapları arasında yer alır. Bu nedenle, çözünme özellikleri açısından amonyum tuzları alkali metal tuzlarına benzerler. Alkali metaller çok aktif (elektropozitif) olmaları nedeniyle elementel biçime kolayca indirgenemezler. Serbest elementlerin elde edilmesi erimiş klorürlerinin elektrolizi yoluyla yapılır. Son olarak bu konu hakkında geçmişte birçok araştırma yapıldığı gibi bundan sonra da araştırmalar yapılmaya devam edecek ve yeni bilgiler bizlere ulaştırılacaktır. Bilgiyle kalın…
