Enzimlerin görevleri nelerdir, enzimlerin yapısı nasıldır, enzimlerin mekanizmaları nasıldır, enzimler vücuttaki görevleri nedir, enzimlerin özellikleri nelerdir.
Enzimlerin Görevleri
- Reaksiyon hızının canlı için yeterli olması
- Reaksiyonun başlaması için gerekli aktivasyon enerjisinin düşürülmesi
- Reaksiyon oluşurken açığa çıkan enerjinin canlıya zarar vermeyecek düzeyde tutulması
Enzimin Yapıları ve Mekanizmaları
Enzimlerin Yapısı
Enzimler genelde küresel proteinlerdir, büyüklük olarak 62 amino asitten (4-oksalokrotonat totomeraz’ın monomeri) 2500 amino asitten fazlasına (hayvan yağ asit sentaz) kadar uzanırlar. Az sayıda RNA-temelli biyolojik katalizörler de mevcuttur, bunların en yaygın olanıribozomdur, bunlara ya RNA-enzim veya ribozim denir.
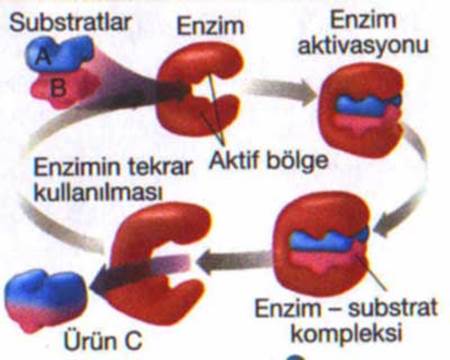
Enzimlerin etkinliği onların üç boyutlu yapısı tarafından belirlenir. Çoğu enzim etki ettikleri substratlardan çok daha büyüktür ve enzimin sadece ufak bir bölümü (3-4 amino asit kalıntısı) doğrudan kataliz ile doğrudan ilişkilidir. Bu katalitik amino asit kalıntıların bulunduğu, substrata bağlanan ve tepkimeyi yürüten bölge aktif merkez (veya aktif bölge) olarak adlandırılır. Enzimlerde ayrıca kataliz için gerekli olan kofaktörlerin bağlandığı konumlar da mevcuttur. Bazı enzimlerde ayrıca katalizlenen tepkimenin endirekt substrat veya ürünleri olan küçük moleküllerin bağlandığı başka yerler vardır. Bu bağlanma enzimin aktivitesini artırabilir veya azaltabilir, bu da geri beslemeli bir düzenleme yoludur.
Çoğu protein gibi enzimler de uzun amino asit zincirlerinden oluşur, bunlar katlanır ve üç boyutlu bir yapı oluşturur. Her amino asit dizisi, kendine has özellikleri olan özgül bir yapı oluşturur. Tek başına protein zincirleri bazen gruplanarak protein kompleksleri oluşturabilir. Çoğu enzim ısı veya bazı kimyasal etmenlerle denatüre olur, yani proteinin üç boyutlu yapısının bozulması sonucu katlanmış hali açılır ve inaktive olur. Enzime bağlı olarak denatürasyon tersinir olabilir veya olmayabilir.
Özgüllük
Enzimler genelde hangi tepkimeleri katalizledikleri ve bu tepkimelerdeki substratlar konusunda çok özgüldürler. Enzim ve substratlarının birbirini tamamlayıcı şekil, yük ve hidrofilik/hidrofobik özellikleri bu özgüllüğü meydana getirir. Enzimler ayrıca steroizomerik, yönsel vekimyasal özgüllük de gösterebilirler.
En yüksek seviyede özgüllük ve doğruluk gösteren enzimler genomun kopaylanması ve ifadesi ile ilişkilidir. Bu enzimlerin “prova okuma” mekanizmaları vardır. DNA polimeraz gibi bir enzim, ilk aşamada bir reaksiyonu katalizler, ikinci aşamada da ürünün doğruluğunu kontrol eder. Bu iki adımlı süreç sayesinde yüksek sadakatli polimerazlarda ortalama hata oranı 100 milyon reaksiyonda 1’den az olur. Benzer prova-okuma mekanizmaları RNA polimeraz, aminoasil tRNA sentetaz ve ribozomlarda da vardır.
İkincil metabolit üreten bazı enzimler ayırım gözetmediği söylenir, çünkü göreceli olarak geniş bir substrat grubuna etki edebilirler. Substrat spesifisitesindeki bu genişlik sayensinde yeni metabolik yolların evrimleşebildiği öne sürülmüştür.
“Anahtar kilit” modeli
Enzimler hangi tepkimeyi katalizledikleri ve bu tepkimeye hangi substratın girdiğine çok büyük bir özgüllük gösterirler. 1894’te Emil Fischer bunun nedeninin, enzim ve substratının birbirine tam uyan tamamlayıcı geometrik şekilleri olmasından dolayı olduğunu öne sürmüştür. Bu fikre sıkça “anahtar kilit” modeli olarak değinilir. Bu model enzim özgüllüğünü açıklasa da geçiş halinin enzim tarafından stabilizasyonunu açıklamaz. “Anahtar ve kilit” modeli artık yetersiz sayılmaktadır, “indüklenmiş uyum” (İng. induced fit) modeli halen en yaygın kabul gören enzim-substrat-koenzim şeklidir.
İndüklenmiş uyum modeli
1958’de Daniel Koshland anahtar ve kilit modelinin bir modifikasyonunu öne sürdü: enzimler göreli olarak esnek yapılar olduklarına göre, substrat enzimle etkileşirken aktif merkezin şekli sürekli olarak substrat tarafından değiştirilmektedir. Bunun sonucu olarak, substrat sadece hareketsiz bir aktif merkeze bağlanmıyor, aktif merkezi oluşturan amino asit yan zincirleri biçim alarak enzimin katalitik işlevini yerine getirmesini sağlıyorlar. Bazı durumlarda, örneğin glikozidazlarda, substrat molekül de aktif merkeze girerken şeklini biraz değiştirir. Substrat tamamen bağlanana kadar aktif merkez şeklini değişitirir, o noktada en son şekil ve yükü belirlenmiş olur.
Enzimlerin Mekanizmaları
Enzimler birkaç farklı yolla çalışırlar, bunların hepsi aktivasyon enerjisini azaltır:
- Geçiş durumunu stabilize olduğu bir ortam yaratarak (örneğin, substratın şeklini zorlayarak – substrat/ürün molekülünün geçiş hâl biçimine bağlanarak enzim bağlı substrat(ları) çarpıtır ve geçişin tamamlanması için gerekli enerji miktarını azaltır)
- Geçiş halinin enerjisini azaltarak, örneğin geçiş halindekinin tersi bir yük dağılımına sahip bir ortam yaratarak.
- Alternatif bir yol sağlayarak. Örneğin, substratla geçici olarak tepkiyerek bir ES kompleksi oluşturarak.
- Substratları tepkimeleri için onları doğru yönde bir araya getirerek tepkime entropi değişikliğini azaltarak.
İlginç bir şekilde, bu entropik etki, temel halin destabilizasyonu ile ilişkilidir, ve katalize olan katkısı göreli olarak düşüktür.
Geçiş hali stabilizasyonu
Aktivasyon enerjisi azalmasını anlamak için onun geçiş halinin katalizlenmemiş tepkimenin geçiş haline kıyasla enzim tarafından nasıl stabilize edildiğinin bilmek gerekir. Büyük bir stabilizasyon elde etmenin en etkili yolu elektrostatik etkiler kullanmaktır, özellikle geçiş halinin yük dağılımına doğru yönlenmiş, nispeten sabit polar bir ortam oluşturarak. Suda cereyan eden katalizlenmeyen tepkimede böylesi bir ortam yoktur.
Dinamik ve işlevler
Yakın zamanlarda yapılan araştırmalar sonucunda enzimlerin iç dinamikleri ile kataliz mekanizması arasındaki ilişki daha iyi anlaşılmaya başlamıştır. Bir enzimin iç dinamikleri onun iç kısımlarının (örneğin bir grup amino asit, bir ilmik bölgesi, bir alfa sarmal, komşu beta yapraklar ve hatta bütün bir bölge) hareketleridir. Bu hareketler femtosaniyelerden saniyelere kadar uzanan zaman ölçeklerinde cereyena edebilir. Bir enzimin yapısının içinde yer alan protein kalıntılarının oluşturduğu ağlar, hareketleri ile katalize katkıda bulunabilirler. Protein hareketleri pekçok enzim için çok önemlidir, ama küçük ve hızlı titreşimlerin mi, büyük ve yavaş hareketlerin mi daha önemli olduğu tepkimenin tipine bağlıdır. Ancak, bu haketler substrat ve ürülerin bağlanma ve salınmaları için önemli olsalar da, protein hareketlerinin enzimatik tepkimelerdeki kimyasal adımları hızlandırdığı belli değildir. Bu bulgular alosterik etkilerin anlaşılmasında ve yeni ilaçların keşfinde önemli uzantıları vardır.
Alosterik modülasyon
Alosterik enzimler, effektörlerine bağlanmaya cevaben yapılarını değiştirirler. Eğer effektör molekül doğrudan enzimdeki bağlanma yerlerinden birine bağlanırak katalitik aktiviteye etki ederse modülasyon doğrudan olur, allosterik enzimle etkileşen başka protein veya protein alt birimlerine bağlanıyorsa modülasyon dolayı olur.