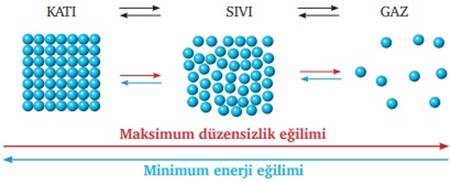
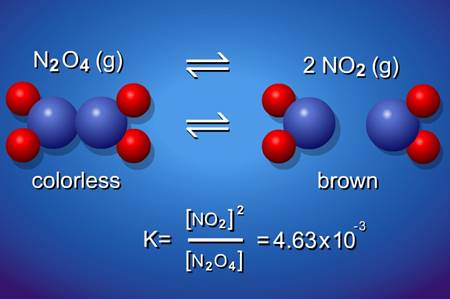
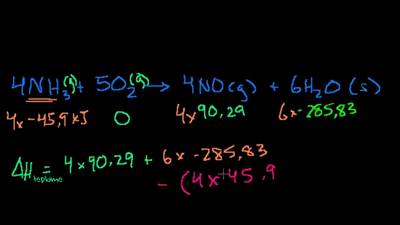Le Chatelier İlkesi Nedir? Dengede olan bir kimyasal tepkimeye dışarıdan müdahale edildiğinde (sıcaklık değişimi, basınç değişimi, girenlerin ve ürünlerin derişimlerindeki değişim) tepkimenin dengesi bozulur ve bu denge hali tekrar oluşana kadar tepkime girenler ya da ürünler yönüne doğru hareket eder. Yani dengedeki bir sisteme dışarıdan müdahale edildiğinde sistem, bu dışarıdan edilen müdahaleyi azaltmak için tepki […]