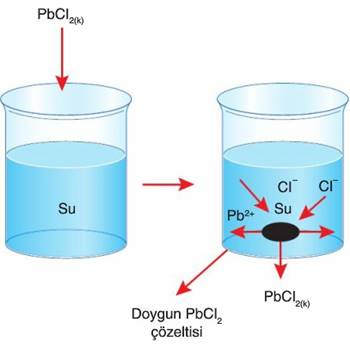
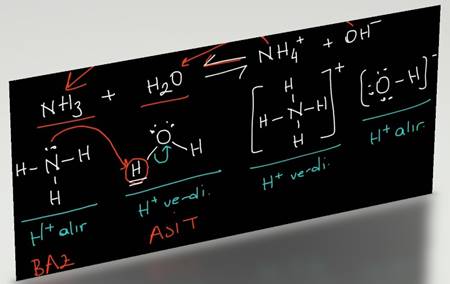
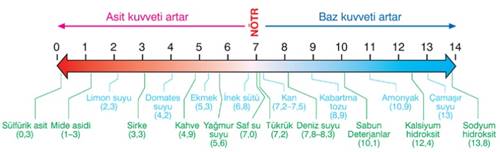
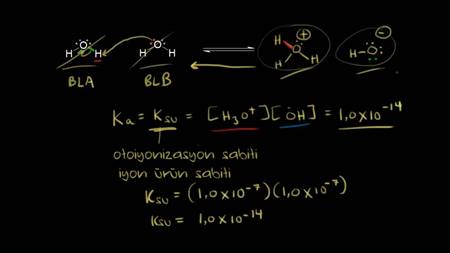Şeker ve Su Nasıl Ayrılır? Şeker ve Su Karışımı Hangi Karışım Türüdür? konusu Kimya alanına ait bir konudur ve bizler bu konu hakkında detaylı olarak bilgi vermeye çalışacağız. Şeker ve Su Nasıl Ayrılır? Şeker ve Su Karışımı Hangi Karışım Türüdür? konusu ile ilgili daha fazla bilgiye ihtiyacınız olursa sitemizde arama yapmanızı öneririz. Yorum bölümünden Şeker ve Su Nasıl Ayrılır? Şeker ve Su Karışımı Hangi Karışım Türüdür? konusu hakkındaki düşüncelerinizi bizimle paylaşabilirsiniz.