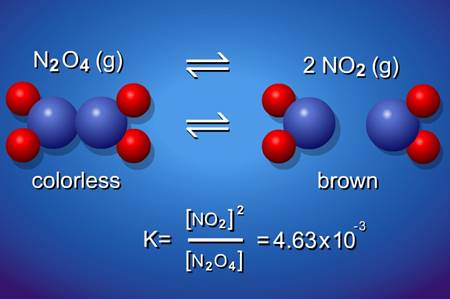
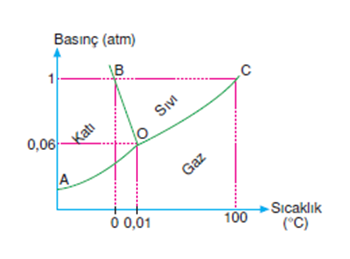
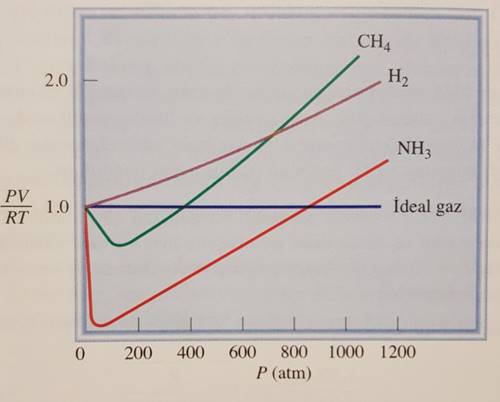
Tersinir Tepkime ve Kimyasal Denge Nedir? Bir kimyasal dengenin olabilmesi için tepkimenin Tersinir Tepkime olması gerekir. Peki tersinir tepkime nedir? Bu şöyle anlatmaya çalışalım: tepkimeye giren A ve B girdileri C ve D ürünlerini oluşturduktan sonra eğer C ve D ürünleri tekrar A ve B girdilerini oluşturabiliyorsa bu tersinir tepkimedir. Kimyasal denge ise bu tersinir […]